1. はじめに
2020年にノーベル化学賞を受賞したCRISPR-Cas9技術は、遺伝子編集の世界に革命をもたらしました。しかし、この画期的な技術にも課題がありました。それは、DNAを「切断」することで生じる予期しない変異や、細胞の修復メカニズムに依存する不確実性です。
現在、科学者たちはCRISPR技術の新たな進化形を開発しています。それが、トランスポゾン(動く遺伝子)を利用した「切断不要の遺伝子挿入技術」です。この技術は、DNAを切らずに、まるでワープロソフトで文章を編集するように、正確に遺伝情報を書き換えることを可能にします。
本記事では、CRISPR技術がどのように進化し、次世代のゲノム編集がどのような未来を切り開くのかを解説します。
2. CRISPR技術の進化
2-1. 第一世代:切断型CRISPR-Cas9
CRISPR-Cas9は、細菌が持つ免疫システムを応用した技術です。細菌は、過去に侵入したウイルスのDNA断片を「CRISPR配列」として記憶し、再び同じウイルスが侵入した際に、Cas9というタンパク質を使ってウイルスのDNAを切断して無力化します。
この仕組みを応用したCRISPR-Cas9技術は、ガイドRNAと呼ばれる短いRNA分子を使って、ゲノム上の狙った場所にCas9タンパク質を誘導し、DNAを切断します。切断された部分は細胞の修復機構によって修復されますが、この過程で遺伝子を破壊したり、新しい遺伝子を挿入したりすることができます。
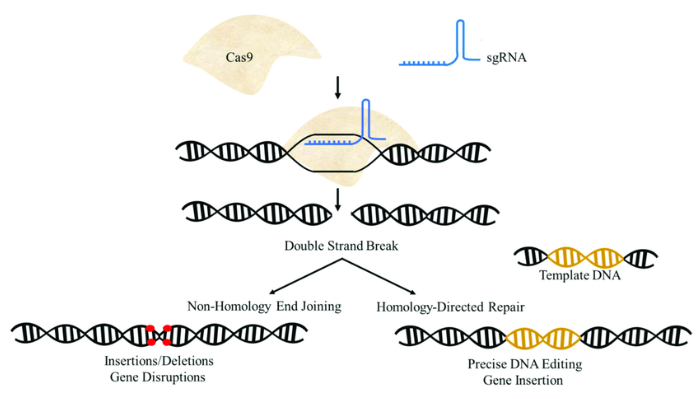
しかし、この「切断と修復」のプロセスには問題がありました。DNA切断部位で予期しない変異が生じることがあり、また、細胞の修復メカニズムに依存するため、意図した編集結果が得られない場合もありました。特に、大きな遺伝子配列を正確に挿入することは困難でした。
2-2. 第二世代:転写制御型CRISPR
これらの課題を受けて、科学者たちは「切断しないCRISPR」の開発に取り組みました。その一つが、CRISPRi(CRISPR interference)と呼ばれる転写制御技術です。
CRISPRiでは、切断能力を失わせた「死んだCas9(dCas9)」を使用します。このdCas9は、ガイドRNAに従って標的DNAに結合しますが、切断はしません。代わりに、DNA上に「物理的な障壁」として存在することで、遺伝子の転写(遺伝情報がRNAに写し取られるプロセス)を阻害します。
この技術により、遺伝子を破壊することなく、その機能を一時的にオフにすることが可能になりました。遺伝子の機能を研究する上で非常に有用なツールとなっています。
3. トランスポゾンとの融合技術
3-1. 動く遺伝子「トランスポゾン」とは
CRISPR技術のさらなる進化を理解するためには、「トランスポゾン」という遺伝因子について知る必要があります。
トランスポゾンは、1940年代に遺伝学者バーバラ・マクリントック博士によって発見された「動く遺伝子」です。これらの遺伝因子は、ゲノム内のある場所から別の場所へと自らを移動させる能力を持っています。マクリントック博士は、トウモロコシの研究からこの現象を発見し、1983年にノーベル生理学・医学賞を受賞しました。
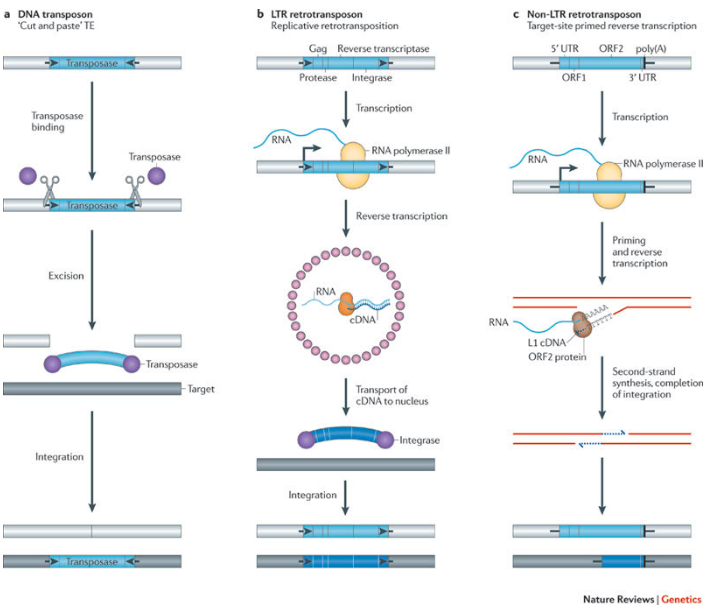
トランスポゾンには様々なタイプがありますが、その中でも「Tn7型トランスポゾン」は特に興味深い特性を持っています。このタイプのトランスポゾンは、ゲノム内の特定の「安全な場所」を認識して移動する能力を持ち、重要な遺伝子を破壊しないように進化してきました。
近年の研究で、一部の細菌が持つCRISPRシステムが、このTn7型トランスポゾンと融合した形で存在することが発見されました。これらのシステムでは、CRISPR関連タンパク質が存在するにもかかわらず、DNA切断酵素の成分が欠落していました。つまり、自然界において既に「切断しないCRISPR」が存在していたのです。
3-2. CRISPR-Tnの仕組み
CRISPR-トランスポゾン融合システム(CRISPR-Tn、またはCAST)は、CRISPRの標的認識能力とトランスポゾンの遺伝子挿入能力を組み合わせた革新的な技術です。
このシステムの動作原理は以下の通りです:
ステップ1:標的認識 ガイドRNAが、編集したいDNA配列に結合します。これは従来のCRISPR-Cas9と同じメカニズムです。
ステップ2:タンパク質複合体の形成 ガイドRNAと結合したCRISPR関連タンパク質が、トランスポゾンに関連するタンパク質(TnsABCなど)と複合体を形成します。
ステップ3:遺伝子の挿入 DNAを切断することなく、トランスポゾン由来の酵素が標的部位の近くに新しい遺伝子配列を挿入します。このプロセスは「コピー&ペースト」型の挿入で、元のトランスポゾン配列はそのまま残り、コピーが新しい場所に挿入されます。
この技術の最大の利点は、DNA二本鎖切断を引き起こさないことです。切断による細胞ストレスや予期しない変異のリスクを大幅に低減できます。さらに、数キロベース(数千塩基対)にも及ぶ大きな遺伝子配列を、高い精度で挿入できる可能性があります。
4. 実用化への展望
4-1. 医療応用の可能性
CRISPR-Tn技術は、遺伝子治療の分野に大きな可能性をもたらします。
遺伝性疾患の治療 多くの遺伝性疾患は、特定の遺伝子が欠損していることが原因です。従来のCRISPR-Cas9では、遺伝子を破壊することは比較的容易でしたが、正常な遺伝子を正確に挿入することは困難でした。CRISPR-Tn技術は、この「挿入」を安全かつ効率的に行える可能性があります。
例えば、鎌状赤血球症やデュシェンヌ型筋ジストロフィーなど、特定の遺伝子の機能不全が原因の疾患に対して、正常な遺伝子を患者の細胞に挿入する治療が考えられます。
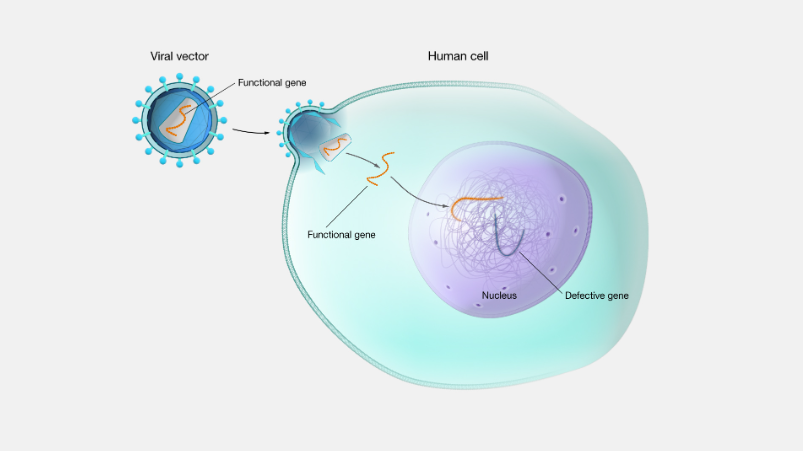
がん免疫療法の改良 CAR-T細胞療法などのがん免疫療法では、患者のT細胞に新しい遺伝子を導入して、がん細胞を認識・攻撃できるように改変します。現在はウイルスベクターを使用していますが、CRISPR-Tn技術を使えば、より安全で正確な遺伝子導入が可能になるかもしれません。
希少疾患への対応 患者数が少ない希少疾患は、治療法の開発が進みにくいという問題があります。CRISPR-Tn技術は、個々の患者の遺伝的背景に合わせた「オーダーメイド医療」を実現する可能性があります。
4-2. 安全性の向上
遺伝子編集技術の実用化において、最も重要な課題の一つが「オフターゲット効果」です。これは、意図した場所以外のゲノム領域が編集されてしまう現象です。
CRISPR-Cas9では、DNA切断が引き金となってオフターゲット変異が生じることがありました。CRISPR-Tn技術は切断を伴わないため、このリスクが大幅に低減される可能性があります。
また、DNA二本鎖切断は細胞に大きなストレスを与え、細胞死や染色体異常を引き起こすことがあります。切断不要のCRISPR-Tn技術は、細胞への負担が少なく、より安全な治療法の開発につながると期待されています。
さらに、挿入される遺伝子配列のサイズが大きくても対応できるため、複雑な遺伝子治療にも応用できる可能性があります。
5. まとめ
CRISPR技術は、誕生から10年余りで驚くべき進化を遂げてきました。第一世代の「切断型」CRISPR-Cas9から、転写制御型、そしてトランスポゾンと融合した「切断不要の挿入型」へと発展しています。
CRISPR-Tn技術は、遺伝子編集のパラダイムを「削除と破壊」から「正確な書き込み」へと転換させる可能性を秘めています。DNA切断を伴わないことで安全性が向上し、大きな遺伝子配列を正確に挿入できることで、これまで困難だった遺伝子治療が実現するかもしれません。
もちろん、この技術が実際の医療現場で使用されるまでには、まだ多くの研究と臨床試験が必要です。しかし、自然界に存在した「切断しないCRISPR」を人類が発見し、応用しようとしている事実は、生命科学の未来に大きな希望をもたらしています。
遺伝子編集技術の進化は、私たちが遺伝性疾患や難病とどう向き合うかを変えていくでしょう。CRISPR-Tn技術は、その次の一歩を示す重要な技術革新なのです。
参考文献
関連特許文献(Google Patents)
- US10227581B2 – “Engineered transcription activator-like effector (TALE) domains and uses thereof”
https://patents.google.com/patent/US10227581B2/
TALE(転写活性化様エフェクター)ドメインの工学的改変に関する特許 - US10113163B2 – “Adenosine nucleobase editors and uses thereof”
https://patents.google.com/patent/US10113163B2/
アデノシン塩基編集技術とその用途に関する特許 - US20200255830A1 – “Novel crispr-associated transposon systems and components”
https://patents.google.com/patent/US20200255830A1/en
CRISPR関連トランスポゾンシステムとその構成要素に関する特許
参考文献
- Klompe, S. E., et al. (2019). “Transposon-encoded CRISPR–Cas systems direct RNA-guided DNA integration.” Nature, 571(7764), 219-225.
https://www.nature.com/articles/s41586-019-1323-z - Strecker, J., et al. (2019). “RNA-guided DNA insertion with CRISPR-associated transposases.” Science, 365(6448), 48-53.
https://www.science.org/doi/10.1126/science.aax9181 - Qi, L. S., et al. (2013). “Repurposing CRISPR as an RNA-guided platform for sequence-specific control of gene expression.” Cell, 152(5), 1173-1183.
https://doi.org/10.1016/j.cell.2013.02.022 - National Human Genome Research Institute. “CRISPR”
https://www.genome.gov/genetics-glossary/CRISPR - National Human Genome Research Institute. “Gene Therapy”
https://www.genome.gov/genetics-glossary/Gene-Therapy

コメント